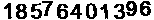醫(yī)liao器械FDA認(rèn)證咨詢(xún)輔導(dǎo)-申請(qǐng)F(tuán)DA注冊(cè)一類(lèi)二類(lèi)三類(lèi)
|
|
|||||||||||||||||
詳細(xì)介紹
美國(guó)FDA隸屬于美國(guó) 國(guó)wu院保jian與服wu部的公共健kang服務(wù)署,,負(fù)責(zé)美國(guó)所有有關(guān)食pin,,藥pin,,化zhuang品及輻she性?xún)x器的管理,,它也是美國(guó)**早的消fei者保護(hù)機(jī)構(gòu)。FDA不僅搜集處理80,,000項(xiàng)美國(guó)境內(nèi)制造或進(jìn)kou的產(chǎn)品樣品并施以檢驗(yàn),,而且,每年派遣上千名檢查員,,奔赴海外15,000個(gè)工廠,,以確認(rèn)他們的各種活動(dòng)是否符美國(guó)的法lv規(guī)定。
深圳市肯達(dá)信企業(yè)管理顧問(wèn)有限公司(總部)
關(guān)于FDA認(rèn)證咨詢(xún)輔導(dǎo)可詳詢(xún)MISS王
156 2656 5226
美國(guó)FDA對(duì)醫(yī)Liao器械有明確和嚴(yán)格的定義,,其定義如下:“所謂醫(yī)Liao器械是指符以下條件之儀器,、裝置、工具,、機(jī)械,、器具,、插入管、體外試劑及其它相關(guān)物品,,包括組件,、零件或附件:明確列于National Formulary或the Unite States Pharmacopeia或前述兩者的附錄中者;預(yù)期使用于動(dòng)物或人類(lèi)疾bing,,或其它身體狀況之診斷,,或用于疾bing之治yu、減緩與治liao者,;預(yù)期影xiang動(dòng)物或人體身體功能或結(jié)構(gòu),,但不經(jīng)由新陳代謝來(lái)達(dá)到其主要目的者”。
只有符以上定義的產(chǎn)品方被看作醫(yī)Liao器械,,在此定義下,,不僅醫(yī)yuan內(nèi)各種儀器與工具,即使連消fei者可在一般商店購(gòu)買(mǎi)之眼鏡框,、眼鏡片,、牙刷與按摩器等健器材等都屬于FDA之管理范圍,。它與國(guó)內(nèi)對(duì)醫(yī)Liao器械的認(rèn)定稍有不同,。
根據(jù)風(fēng)xian等級(jí)的不同,F(xiàn)DA將醫(yī)Liao器械分為三類(lèi)(Ⅰ,,Ⅱ,,Ⅲ),Ⅲ類(lèi)風(fēng)xian等級(jí)**gao,。FDA將每一種
醫(yī)Liao器械都明確規(guī)定其產(chǎn)品分類(lèi)和管理要求,,F(xiàn)DA醫(yī)Liao器械產(chǎn)品目錄中共有1,700多種,。任一種醫(yī)Liao器械想要進(jìn)入美國(guó)市場(chǎng),,必xu*先弄清申qing上shi產(chǎn)品分類(lèi)和管理要求。
FDA針對(duì)醫(yī)Liao器械制訂了許多法an,,并不時(shí)地進(jìn)行修改和補(bǔ)充,,但根本的法安并不多,主要包括:聯(lián)bang食pin,、藥pin與化zhuang品法案(FD&C Act,,根本法安;公眾健kang服務(wù)法安,;公正包裝和標(biāo)識(shí)法an健kang和安quan輻she控zhi法an,;安quan醫(yī)Liao器械法an;現(xiàn)代化法an對(duì)這些法anFDA給予了非常詳細(xì)的解釋?zhuān)⑴涮子芯唧w的操zuo要求,。企業(yè)在計(jì)劃進(jìn)入美國(guó)市場(chǎng)前,,需仔細(xì)評(píng)gu針對(duì)自己產(chǎn)品相關(guān)的法gui和具體要求(包括不同的美國(guó)產(chǎn)品標(biāo)zhun要求),。
在明確了以上信息后,企業(yè)就可以著手準(zhǔn)備有關(guān)的申bao資liao,,并按一定程序向FDA申bao以獲取批zhun認(rèn)可,。對(duì)于任he產(chǎn)品,企業(yè)都需進(jìn)行企業(yè)注ce(Registration)和產(chǎn)品列名(Listing),。對(duì)Ⅰ類(lèi)產(chǎn)品(占47%左右),,實(shí)行的是一般控zhi(General Control),絕大部分產(chǎn)品只需進(jìn)行注cce,、列名和實(shí)施GMP規(guī)范,,產(chǎn)品即可進(jìn)入美國(guó)市場(chǎng)(其中極少數(shù)產(chǎn)品連GMP也豁,ji少數(shù)保留產(chǎn)品則需向FDA交510(K)申qing即PMN(Premarket Notification)),;對(duì)Ⅱ類(lèi)產(chǎn)品(占46%左右),,實(shí)行的是特殊控zhi(Special Control),企業(yè)在進(jìn)行注ce和列名后,,還需實(shí)施GMP和遞jiao 510(K)申qing(極少產(chǎn)品是510(K)豁免),;對(duì)Ⅲ類(lèi)產(chǎn)品(占7%左右),實(shí)施的是上shi前許ke,,企業(yè)在進(jìn)行注ce和列名后,,須實(shí)施GMP并向FDA遞jiaoPMA(Premarket Application)申qing部分Ⅲ類(lèi)產(chǎn)品還是PMN)。
對(duì)Ⅰ類(lèi)產(chǎn)品,,企業(yè)向FDA遞交相關(guān)資liao后,,F(xiàn)DA只進(jìn)行g(shù)ong告,并無(wú)相關(guān)證jian發(fā)給企業(yè),;對(duì)Ⅱ,、Ⅲ類(lèi)器械,企業(yè)須遞交PMN或PMA,,F(xiàn)DA在公gao的同時(shí),,會(huì)給企業(yè)以正的市場(chǎng)準(zhǔn)ru批zhun函件(Clearance),即允許企業(yè)以自己的名在美國(guó)醫(yī)liao器械市場(chǎng)上直接銷(xiāo)shou其產(chǎn)品,。至于申qing過(guò)程中是否到企業(yè)進(jìn)行現(xiàn)場(chǎng)GMP考和,,則由FDA根據(jù)產(chǎn)品風(fēng)xian等級(jí)、管理要求和市場(chǎng)反饋等綜合因素決定,。
深圳市肯達(dá)信企業(yè)管理顧問(wèn)有限公司(總部)
關(guān)于FDA認(rèn)證咨詢(xún)輔導(dǎo)可詳詢(xún)MISS王
156 2656 5226
聯(lián)系方式
|